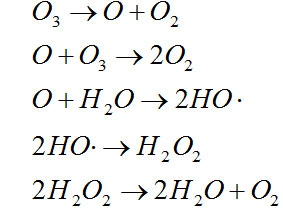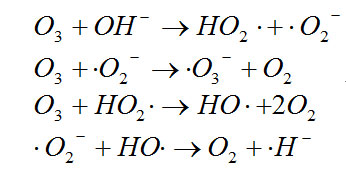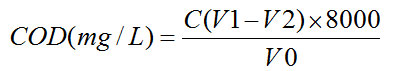一、实验目的和要求
自臭氧应用于水处理以来,在实际应用中取得了明显的成效。但臭氧氧化反应具有一定的选择性,氧化产物常常为小分子羧酸,酮和醛类物质,难以将有机物彻底降解为CO
2、H
2O 或其它无机物,因此TOC 和COD
cr 去除率不是很高。
为了强化臭氧处理效果,人们开发出O
3/UV、O
3/H
2O
2/UV、O
3/固体催化剂(如活性炭,金属及其氧化物)等高级氧化技术,其共同特征是产生高活性羟基自由基(·OH),从而达到彻底降解有机污染物的目的。影响臭氧氧化的因素有污染物成分、含量,臭氧投加量,废水pH,水气接触时间,紫外波长,照射强度,气体分布状况,水温等。
本实验希望达到下述目的:①加深对臭氧氧化法处理废水机理的理解;
②掌握臭氧氧化法处理废水的很佳条件试验方法。
二、实验内容和原理
臭氧氧化能力很强,O
3+2H
++2e→O
2+H
2O反应体系的标准电极电位E=2.07V。臭氧在水中分解产生原子氧和氧气还可以产生一系列自由基,其反应式如下:
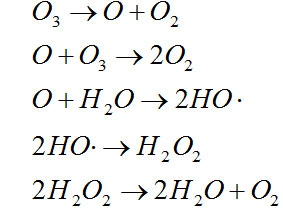
特别是在碱性介质中,O
3分解产生自由基的速度很快,其反应式为:
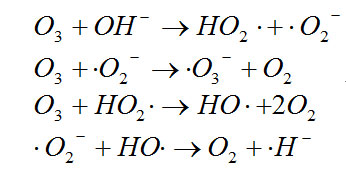
新生成的羟基自由基尤其活泼,氧化能力更强,HO﹒+H
t+e→H
2O,反应体系的标准电极电位Eo=2.80V。臭氧与水中有机物的反应十分复杂,既有臭氧的直接氧化反应,也有新生自由基的氧化反应。这与反应条件与有机物的性质密切相关,酸性条件下,臭氧分解慢,O
3的直接氧化反应起主要作用;碱性条件下,臭氧分解快,羟基自由基氧化作用加大,随着溶液pH提高,COD
cr去除率增加,氧化率提高。另外,温度升高,臭氧分解速度加快,且化学反应速率提高,所以高温有利于有机物氧化。
三、主要仪器设备装置
常用实验室仪器;O
3反应器,剩余O
3消除器;加热-回流装置;25mL酸式滴定管;防暴沸玻璃珠;pHS型pH计1台;50ml烧杯若干;100ml量筒各8只,20ml、10ml移液管各1支。
蒸馏水;硫酸银,化学纯;硫酸,ρ=1.84g/mL;硫酸银-硫酸试剂;重铬酸钾标准溶液(c=0.25mol/L);硫酸亚铁铵标准滴定溶液(c=0.1006mol/L);试亚铁灵指示剂溶液。
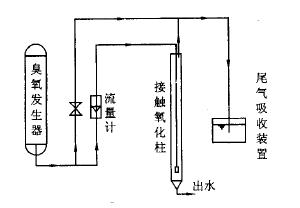
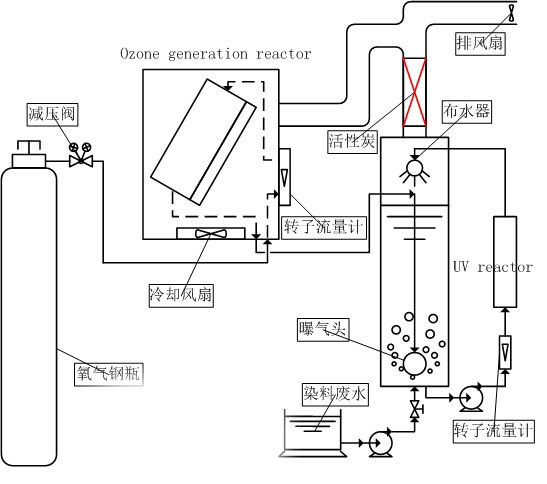
图1 臭氧降解印染废水研究实验装置
四、操作方法和实验步骤
Ø 不同氧化时间的处理效果的实验步骤
1、 仔细观察O
3装置的内、外结构及部件;
2、 开启泵,将废水打入O
3反应器,调整流量为0.3g/L,同时测定原废水的pH、COD
cr值;
3、 打开氧气瓶和减压阀,调整臭氧发生器的进气流量为0.1m
3/h;
4、 打开电源开关,设置放电功率为80%,使其产生稳定的臭氧浓度;
5、 经氧化反应10min、20min、30min、40min、50min后分别取一定的水样,分别测定不同氧化时间后出水的pH、COD
cr值。
6、 实验完成后,关闭电源开关、臭氧发生器及泵,整理实验。
Ø 水质化学需氧量测定的实验步骤
1) 移液管取20.0mL待测试料于洁净的250ml锥形瓶中。
2) 于试料中加入10.0mL重铬酸钾标准溶液和几颗防爆沸玻璃珠,摇匀。将锥形瓶接到回流装置冷凝管下端,接通冷凝水。从冷凝管上端缓慢加入30ml硫酸银—硫酸试剂,以防止低沸点有机物的逸出,混合均匀后开始加热,自溶液开始沸腾起回流1小时。
3) 充分冷却后,用20—30mL水自冷凝管上端冲洗冷凝管2-3次,取下锥形瓶。
4) 待溶液冷却至室温后,加入3滴试亚铁灵指示剂溶液,用硫酸亚铁铵标准滴定溶液滴定,溶液的颜色由黄色经蓝绿色变为红褐色即为终点。记下硫酸亚铁铵标准滴定溶液的消耗毫升数V
2。
空白试验:
按相同步骤以20.0ml蒸馏水代替试料进行空白试验,记录下空白滴定时消耗硫酸亚铁铵标准溶液的毫升数V
1。
五、实验数据记录和处理
表1 (NH
4)
2Fe(SO
4)
2浓度标定及空白试验数据表
|
(NH4)2Fe(SO4)2浓度标定实验 |
(NH4)2Fe(SO4)2用量/ml |
(NH4)Fe(SO4)2浓度 |
|
25.42 |
0.098mol/L |
|
25.50 |
|
全程空白实验 |
24.61 |
24.65 |
|
24.90 |
|
24.45 |
水质COD测定:
重铬酸钾标准溶液浓度c(1/6 K
2Cr
2O
7)=0.2500mol/L,标定得(NH
4)
2Fe(SO
4)
2的浓度C =0.098mol/L;空白试验所消耗的硫酸亚铁铵标准滴定溶液的体积V1=24.65mL;试料测定所消耗的硫酸亚铁铵标准滴定溶液的体积V2;试料的体积V0=20.00mL,则:
计算公式:
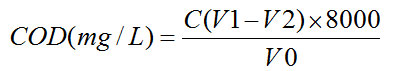
表2 直接桃红染料废水COD测定数据表
|
水样 |
pH值 |
硫酸亚铁铵的
滴定消耗量(mL) |
COD (mg/L) |
COD去除率(%) |
|
原水样(0 min) |
7.20 |
20.89 |
146.27 |
0.0 |
|
10 min水样 |
4.15 |
23.74 |
34.21 |
76.6 |
|
20 min水样 |
4.35 |
24.40 |
8.26 |
94.4 |
|
30 min水样 |
4.65 |
24.20 |
16.12 |
89.0 |
|
40 min水样 |
4.99 |
24.38 |
9.04 |
93.8 |
|
50 min水样 |
5.16 |
24.81 |
-7.86 |
105.4 |
表3 酸性嫩黄染料废水COD测定数据表
|
水样 |
pH值 |
硫酸亚铁铵的
滴定消耗量(mL) |
COD (mg/L) |
COD去除率(%) |
|
原水样(0 min) |
7.21 |
19.60 |
190.70 |
0.0 |
|
10 min水样 |
6.70 |
20.10 |
171.04 |
10.3 |
|
20 min水样 |
6.49 |
20.32 |
162.39 |
14.8 |
|
30 min水样 |
6.07 |
21.20 |
127.79 |
33.0 |
|
40 min水样 |
4.46 |
21.90 |
100.27 |
47.4 |
|
50 min水样 |
4.01 |
22.03 |
95.15 |
50.1 |
表4 分散蓝染料废水COD测定数据表
|
水样 |
pH值 |
硫酸亚铁铵的
滴定消耗量(mL) |
COD (mg/L) |
COD去除率(%) |
|
原水样(0 min) |
6.70 |
15.92 |
352.02 |
0.0 |
|
10 min水样 |
4.35 |
18.72 |
242.26 |
31.2 |
|
20 min水样 |
3.40 |
20.11 |
187.77 |
46.7 |
|
30 min水样 |
3.35 |
20.82 |
159.94 |
54.6 |
|
40 min水样 |
3.31 |
20.80 |
160.72 |
54.3 |
|
50 min水样 |
3.30 |
21.18 |
145.82 |
58.6 |
六、实验结果与分析
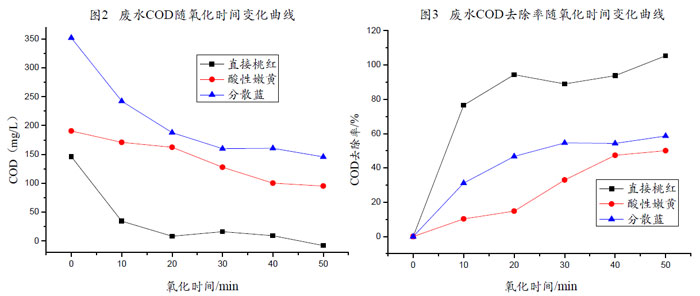
【废水COD及其去除率随氧化时间变化曲线图分析】
从图2、图3不难发现,染料废水的COD均随O
3氧化时间的增长而降低,COD去除率则随之逐渐增大;且臭氧对三种染料废水的COD
Cr去除率有异,自图3可发现实验中任一氧化时间时三种染料的COD
Cr去除率大小为:直接桃红>分散蓝>酸性嫩黄。
COD
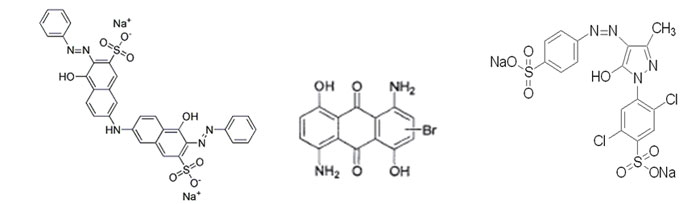
Cr的去除主要取决于有机物被氧化的程度,主要原因是染料分子结构的差异。分子反应活性越强,就越容易降解;分子结构越稳定,就越难降解。三种染料的分子结构式如图5所示:
图5 染料结构图(从左到右分别为直接桃红、分散蓝、酸性嫩黄)
蒽醌结构的染料(如分散蓝),一旦羰基被氧化打开后,整个蒽醌结构就被破坏,羰基相邻的两个苯环就比较容易被氧化;单偶氮结构染料(如酸性嫩黄),偶氮基(-N=N-)被氧化打开后,其相邻的苯环及芳香环并没有被破坏,结构相对比较稳定而不容易被氧化;双偶氮结构的染料,有两个偶氮基,更为稳定,被氧化的难度也就更大,所以在芳香环个数相差不大的前提下,COD
cr降解效率的大小为:蒽醌结构染料>单偶氮结构染料>双偶氮结构染料。
偏酸性和中性条件下,臭氧的氧化作用以直接氧化为主,其氧化能力较弱,选择性较强,从各染料的分子结构中,不难发现各染料的共轭双键的比重排序为:直接桃红>分散蓝>酸性嫩黄。虽然分散蓝结构中氨基和羟基都是供电子基团,能够促进染料的降解,但是羟基和氨基都可以和羰基形成分子内氢键,再加上吸电子基团—Br的抑制作用,染料的分子结构十分稳定而相对直接桃红难以降解;酸性嫩黄为单偶氮结构染料,且—Cl等吸电子基团更抑制其氧化降解,故酸性嫩黄COD
Cr去除率很低。
很经济反应时间点:
根据图2、图3,从经济性的角度来考虑,20min、30min、40min分别是直接桃红、分散蓝和酸性嫩黄的很佳反应时间点,因为所投加的臭氧已得到很充分的利用,在各自的很佳反应时间点以后,虽然COD
cr去除效率依然在不断增加,但其增加的速度已经十分缓慢,而在臭氧的投加量不变的情况下,臭氧的利用率大大地下降,加大了经济成本。
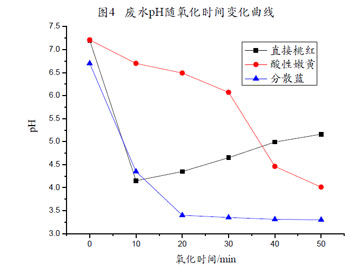
【废水pH值随氧化时间变化曲线图分析】
由图4可发现,酸性嫩黄、分散蓝废水经臭氧处理后水中的pH下降,而直接桃红除很初10min氧化处理水样的pH相对原水样大大降低外,之后的处理水样随氧化时间的增长pH稍有上升。
废水经臭氧氧化过程中有机物不断被氧化为小分子有机酸,酸电离产生氢离子,使水中pH下降,特别是分散蓝染料废水,有机物被臭氧氧化分解后,氢溴酸从分子结构中解离出来,经氧化后产生溴酸等强酸性的酸,所以其pH下降很为明显。而直接桃红的臭氧化过程是:臭氧首先攻击与偶氮键相连的C—N键,使偶氮键以氮气排出,同时分子中苯环和萘环被氧原子取代,开环后被逐步氧化成酚、醇、醛和酰胺等,然后进一步被氧化成有机酸,很后部分有机物被彻底氧化为CO
2和H
2O,因而在氧化得到的有机酸使水样pH下降后,其继续被氧化得到CO
2并逸出使水样pH又小幅度上升。
【实验误差来源分析】
本实验的误差主要来源于水质COD测定,实验测得各水质的COD结果有部分小于50mg/L,根据环境监测原理,此部分水质的COD测定本应采用低浓度的重铬酸钾标准溶液(c=0.025mol/L)氧化,加热回流足够时间以后,采用低浓度的硫酸亚铁铵标准溶液回滴;而本次实验中水质COD测定统一用的重铬酸钾标准溶液c=0.25mol/L,浓度偏高,滴定的准确率势必有所下降。
测定的水质COD结果误差(如测得直接桃红50min氧化水样的COD<0等)来源主要有偏小的原因可能是以下几方面:
(1) 实验中所使用的移液管等各类仪器设备本身带入的移取试料、试剂体积的误差;
(2) 回流过程加入硫酸的速度没有控制好,致使有少量低沸点有机物溢出(加硫酸时锥形瓶中有少量烟冒出,说明低沸点有机物的损失不可忽略);
(3) 考虑到试验时间限制,回流加热时间只有1h(本应为2小时),有机物的氧化可能不够充分;
(4) 滴定终点的判断误差,依赖于实验者观察颜色变化的敏锐度,直接影响硫酸亚铁标准液的浓度标定及水样COD测定结果等;
(5) 本实验COD测定方法的适用范围是COD为30—700mg/L,实验结果中直接桃红部分水样的COD小于30 mg/L,此部分数据存在不可忽略的实验误差。
七、讨论、心得
u 本实验的关键是水质COD的测定;为减少操作带入的实验误差,水质COD测定应注意如下事项:
1) 本实验测量使用原水样,不需过滤;取样时应先放掉一部分染料水样,排除留在取样口处的水样,因为这部分水样时没有被处理的,否则将造成实验误差;
2) 为保证实验数据的精密度,废水取样、各试剂的加入及滴定等同类操作应尽量由同一人完成;
3) 本方法的适用范围是COD大于30 mg/L 小于700mg/L,计算结果COD值小于10mg/L时,应表示为“COD<10mg/L”;若测出的值超出700mg/L,水样必须经稀释后再测定;
4) 滴定实验中,滴定终点的判断非常重要;滴定时要不断旋动锥形瓶,时刻注意瓶中溶液颜色的转变;在酸性重铬酸钾条件下,芳烃及吡啶难以被氧化,其氧化率较低。在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化,所以此方法的准确度不是100%;
5) 硫酸要在装好冷凝管,通好冷凝水之后再缓缓由冷凝管上部加入,要控制加入速度,不宜过快,目的是为了防止低沸点有机物的溢出;
6) 无机还原性物质如亚硝酸盐、硫化物及二价铁盐将使结果增加,将其需氧量作为水样COD值的一部分是可以接受的。该实验的主要干扰物为氯化物,可加入硫酸汞部分地消除干扰,经回流后,氯离子可与硫酸汞结合成可溶性的氯汞络合物。
7) 对于污染严重的水样,可选取所需体积1/10的试料和1/10的试剂,放入10×150mm硬质玻璃管中,摇匀后,用酒精灯加热至沸数分钟,观察溶液是否变成蓝绿色。如呈蓝绿色,应再适当少取试料,重复以上试验,直至溶液不变蓝绿色为止。从而确定待测水样适当的稀释倍数。
u 臭氧浓度过高会对人体造成不利的影响:臭氧浓度高于0.3mg/L时对人的五官有刺激作用;浓度高于3-15mg/L时,人会感到头疼,所以一般臭氧的浓度允许值为0.2mg/L,正常可与人体接触8小时;采用臭氧氧化技术也应该注意剩余臭氧的去除,主要方法有:
i. 预臭氧化:将剩余臭氧重新通入待处理的废水中,可达到循环使用的目的。
ii. 稀释:对排出的臭氧进行一定的稀释,使得臭氧对人体的危害减小。
iii. 热分解:臭氧在100℃时分解反应很剧烈,在270℃时基本没有臭氧的存在。
iv. 吸附:可以采用碘酸钾等物质对臭氧进行吸附去除。
八、思考题:
1、为什么臭氧氧化对TOC的去除效率不是很高?
答:处理液的pH为酸性的情况下,臭氧氧化的选择性较高且反应较慢;处理液pH为碱性的条件下,臭氧氧化分解产生的CO
2又被碱性溶液吸收,故臭氧氧化对TOC的去除率不高。
2、为什么废水在强碱性时其TOC的去除效率反而下降?
答: 随着废水pH的增大,有机物被臭氧氧化产生的CO
2极易被碱性溶液吸收,产生CO
32-及HCO
3-,而这两种离子的存在会抑制羟基自由基的产生,进而抑制有机物氧化作用,所以随着废水pH的升高(强碱性),其TOC的去除率反而变小。
3、化学氧化技术还有哪些方法?
答: 目前常用的化学氧化法根据氧化剂的种类分为有臭氧氧化、Fenton氧化、氯氧化、光催化氧化、湿气氧化法等;根据技术发展的进展可以分为传统氧化法和高新技术氧化法。
臭氧氧化法:臭氧是良好的强氧化脱色剂,对于大多数染料能获得良好的脱色效果,但对于其他以细分散SS状态存在于废水中的还原、硫化和涂料等不溶水染料脱色效果差。实际中常和其他方法联合使用,与紫外光辐射或活性炭吸附联合处理,可提高脱色效果;臭氧-电解处理可提高酸性染料、碱性和活性染料的脱色率。从国内外运行经验和结果来看,由于臭氧氧化不产生污泥和二次污染,有一定的工业应用前景;但处理成本高,不适合大流量废水的处理。
氯氧化法:常用的氯氧化剂有液氯、漂白粉、次氯酸钠和二氧化氯等,氯氧化剂对于易氧化的水溶性染料,如阳离子染料和硫化染料有较好的脱色效果;对于不易氧化的水不溶性染料,如还原、分散染料等脱色效果较差;当废水中含有较多SS和浆料时,氯氧化法去除效果不理想。
Fenton法:Fenton试剂对含染料废水进行混凝前的预处理,脱色率可达96.77%。近年来人们把UV、草酸盐引入Fenton工艺中,使其氧化能力大大增强,但处理毒性大。一般处理氧化物或生物难降解的有机废水时,与混凝沉降、活性炭、生物法等连用,可降低处理成本。
光催化氧化法:常用的催化剂有TiO
2、H
2O
2、草酸铁等无机试剂,TiO
2由于无毒、有较高的催化能力和较好的化学稳定性,成为应用很广泛的光催化剂;利用太阳能进行光催化氧化有机染料技术,在节约能源、维持生态平衡、实现可持续发展等方面具有突出的优点。光催化氧化技术的一个新的发展方向——电化学催化氧化降解技术即光电催化,利用光透电极和结构TiO
2作为工作电极和光催化剂,对水中染料进行电解,发现光电催化剂对3种染料——品红、铬蓝K、铬黑T溶液的降解效果很佳。
超临界氧化法(SCWO):超临界氧化法(SCWO)指当温度、压力高于水的临界温度374℃和临界压力22.05MPa条件下的水中有机物的氧化。Model等对有机碳含量27.33g/L的有机废水,在550℃、60s内,有机碳和有机氯的去除率分别为99.99%和99.97%。SCWO具有效率高、应速度快、适用范围广特点,除有机污染物的同时,可提高生化降解性。
高级氧化法:如UV+H
2O
2、UV+O
3,在氧化过程中产生羟基自由基(·OH),其强氧化性使染料废水脱色。经研究发现它对偶氮染料的脱色很有效,高级氧化反应随O
3和H
2O
2加入量的增加,其反应速率也随之增加。在实际生产中加入某些化学辅助剂会提高脱色效果,很近的研究发现二氯三嗪基型偶氮类活性染料使用UV+H
2O
2方法脱色也有很好的效果。